O hélio foi descoberto pelo francês Pierre Janssen e pelo inglês Norman Lockyer em 1868 ao analisarem o espectro de luz durante um eclipse solar encontrando uma linha de emissão de um elemento desconhecido. Estes resultados foram confirmados por Edward Frankland que deu o nome de helium ao elemento em honra do deus grego do Sol - Hélio
 |
| Edward Frankland |
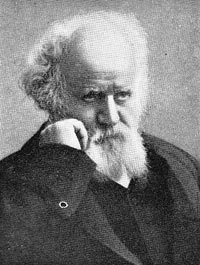 |
| Pierre Janssen |
 |
| Norman Lockyer |
O elemento químico Hélio:
- tem o símbolo químico He;
- pertence ao grupo dos gases nobres (grupo 18) e encontra-se situado no 1º período;
- é um gás monoatómico, incolor e inodoro;
- é o elemento que tem menor ponto de solidificação;
- é o segundo elemento químico mais abundante no universo, atrás do Hidrogénio;
- Possui número atómico 2;
- o seu isótopo mais comum é o Hélio-4.
 |
| Localização do Hélio na Tabela Periódica |
Aplicações do Hélio:
- Por ser um gás inerte e ser mais leve que o ar, o Hélio é utilizado em balões e dirigíveis com fins recreativos, publicitários, reconhecimento de terrenos, filmagens aéreas e para investigação das condições atmosféricas;
- É usado para mergulhos a grandes profundidades através de uma mistura Hélio-oxigénio;
- Aplicações médicas de imagem por Ressonância Magnética;
- A mistura hélio-oxigénio também pode ser usada no tratamento de algumas doenças como a Asma e a Bronquiolite.
 |
| Hélio num dirigível |
Porque é que o Hélio, quando inalado, faz ficar com a voz aguda?
A velocidade do som é aproximadamente 344 m/s, mas, quando a atmosfera se encontra com o gás Hélio, a velocidade aumenta para cerca de 925 m/s. Como o Hélio é mais leve oferece menos resistência, o que significa que quando isto se aplica às cordas vocais, a vibração destas é mais veloz, provocando um tom mais agudo na voz.