Diferentes modelos atómicos:
- Modelo atómico de Dalton: criado no início do século XIX pelo cientista John Dalton imaginando os átomos como corpúsculos indivisíveis e indestrutíveis comparáveis a uma bola de bilhar.
- Modelo atómico de Rutherford: criado no início do século XX pelo cientista neozelandês Ernest Rutherford. Através de uma experiência, imaginou melhor o interior dos átomos: núcleo muito pequeno com carga positiva e onde se concentra toda a massa do átomo; eletrões com carga negativa em movimento à volta do núcleo. Surgindo o primeiro modelo planetário do átomo.
 |
| Experiência feita por Rutherford |
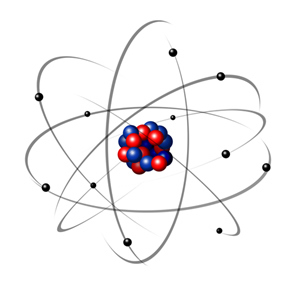
Novo modelo atómico (proposto por Rutherford) semelhante ao Sistema Solar
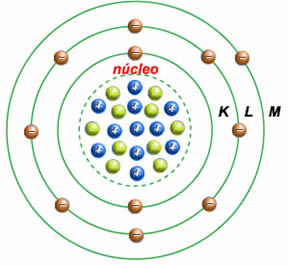
- Modelo atómico de Bohr: criado em 1913 por Niels Bohr para completar o modelo proposto anteriormente (por Rutherford). Bohr concluiu que: os eletrões se moviam à volta do núcleo em órbitas circulares; a cada órbita corresponderia um determinado valor de energia; quanto mais energia tiver a órbita, mais longe se encontra do núcleo.
- Modelo da nuvem eletrónica: o modelo atómico atual. Os eletrões dos átomos movem-se de modo desconhecido e a grandes velocidades, o que forma a nuvem eletrónica (espécie de nuvem não uniforme. A nuvem eletrónica é mais densa próximo do núcleo onde será mais provável encontrar eletrões.
Bibliografia:
-Ciências Físico-Químicas; 9º Ano; FQ - Viver Melhor na Terra; M. Neli G. C. Cavaleiro; M. Domingas Beleza